遼寧重組藥物支原體檢測試劑盒
來源:
發布時間:2025-12-03
針對不同類型的樣品基質,需采用定制化的支原體檢測前處理方案,以消除干擾、提升檢測效果。細胞懸液需經熱處理、樣品處理液作用、細胞碎片去除、濃縮離心,再 55℃消化;上清或高濃度質粒樣品需先濃縮離心,再用樣品處理液作用后 55℃消化;5% 人血白蛋白樣品則采用濃縮離心 + 樣品處理液作用 + 25℃消化的流程。常見干擾基質包括凍存保護劑、高濃度細胞、代謝產物等,優化前處理可遵循三大原則:提取前通過離心取上清或去除抑制劑預處理樣品;高濃度蛋白樣本提取時增加蛋白酶 K 用量,增強蛋白降解效果;細胞類樣品適當降低細胞數或先裂解細胞,減少細胞基質對檢測的干擾。
全血基質中100 CFU/mL支原體,湖州申科支原體檢測試劑盒通過優化提取流程實現穩定擴增與檢出。遼寧重組藥物支原體檢測試劑盒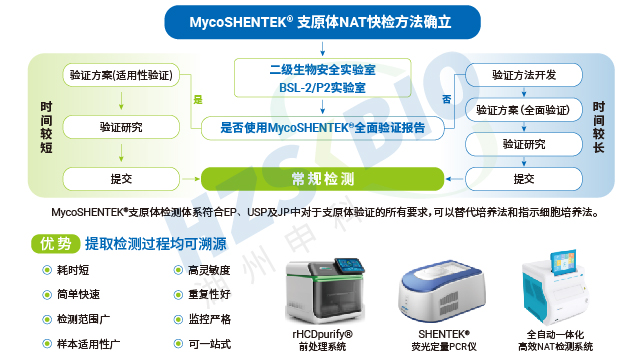
抑制物質檢測是支原體培養法的關鍵前置環節,旨在排除供試品中抑制成分對檢測的干擾。湖州申科按 USP 標準執行:對供試品進行一次抑制物質檢測,若生產方法發生變化可能影響支原體檢測結果,需重復該檢測。檢測通過兩組平行實驗對比實現:一組培養基加入供試品,另一組不加供試品,同步開展營養特性測試,判斷供試品是否含抑制物質。若檢出抑制物質,需通過適當方法中和或抵消其作用,例如使用不含抑制劑的底物,或將供試品稀釋在更大體積的培養基中,確保支原體能在檢測體系中正常生長,避免因抑制成分導致檢測結果失真。
河北重組藥物支原體檢測國產替代高濃度質粒樣品在進行支原體檢測時,需通過濃縮離心預處理,提升支原體檢出率。
湖州申科的支原體驗證菌株以高穩定性與合規性為重點優勢,滿足 NAT 方法驗證需求。菌株來源可靠,均取自國內外合規機構驗證菌株標準盤,溯源至美國 ATCC(口腔、肺炎支原體)、中國 CVCC(豬鼻支原體)等正規保藏機構,獲正式商用授權,標定濃度涵蓋 10CFU 與 100CFU。生產環境合規,在 BSL-2 生物安全實驗室開展,符合國家生物安全法標準,針對不同菌株特性逐個優化生產工藝,涵蓋超 10 種菌株的主代與工作代。質控環節嚴謹,采用高靈敏度培養基(液體、固體、半流體),保障菌落易觀察分離與 CFU 計數準確性;凍存前后均通過固體平皿培養法測定 CFU,聯合合規機構建立數字 PCR 標定方法,經實驗室間對比驗證,準確監控 GC/CFU 比,確保菌株質量達標。
湖州申科推出的 MycoSHENTEK® 支原體驗證菌株,符合全球藥典要求,目前已提供口腔支原體、肺炎支原體、豬鼻支原體三種菌株,后續將逐步擴充其他驗證用菌株。該系列菌株溯源至全球保藏機構并獲得正式授權,經培養法測定 CFU(菌落形成單位)與 dPCR 法測定 GC(基因組拷貝數),實現準確定量標定,濃度涵蓋 10CFU 和 100CFU 兩種規格,每盒含 3 管,完全滿足支原體檢測方法驗證需求。菌株經滅活處理,無風險,使用時只需加入相應體積樣品基質即可開展驗證,操作便捷,同時通過雙重定量檢測確保質量可控,為 NAT 方法驗證提供可靠的標準物質支撐。
支原體檢測取樣需按產品體積設計,10-1000mL 樣品取總體積 1%,保障結果代表性。
培養基的科學選擇與合規使用是支原體培養法檢測成功的基礎,湖州申科按 USP 標準明確了三類推薦培養基的適用場景。Hayflick Media 用于支原體一般性檢測,Frey Media 專門針對滑液囊支原體檢測,Friis Media 則適用于非禽類支原體檢測。為確保少量支原體(約 100cfu 或 100ccu)不被遺漏,需使用足夠數量的固體與液體培養基開展檢測;若選用其他替代培養基,必須嚴格符合 USP 標準要求。此外,每批培養基均需進行針對性的微生物檢測(即營養特性測試),通過標準化的質量把控,避免因培養基性能缺陷導致檢測失效,為后續檢測流程提供穩定可靠的基礎條件。
rHCDpurify 前處理系統可自動化提取支原體 DNA,減少人為誤差提升批間穩定性。遼寧重組藥物支原體檢測試劑盒支原體檢測試劑盒批間穩定性至關重要,需通過多批次驗證確保質量均一。遼寧重組藥物支原體檢測試劑盒
支原體 NAT 檢測中異常曲線的出現多與操作設置、耗材使用或實驗環境相關,需針對性排查解決。首先需確認軟件設置正確性,對照試劑盒說明書檢查時間、溫度、循環數、熒光采集等參數,尤其需注意關閉不含 ROX 試劑的參比熒光功能。其次若擴增曲線無抬升卻出現 CT 值,需調整基線范圍,將起點設為熒光信號穩定的循環數,終點設為擴增曲線起峰前一個循環數。再者需確保耗材與儀器匹配,避免使用普通 PCR 耗材或與加熱模塊規格不符的反應管,防止熒光傳導不佳或熱傳導不充分。此外,曲線先上升后下降可能是反應液蒸發導致,上機前需檢查八連管管蓋無縫隙,避免液面下降干擾結果。
遼寧重組藥物支原體檢測試劑盒
相關新聞
- 四川疫苗產品支原體檢測技術服務 2025-12-05
- 江蘇CHO宿主細胞蛋白(HCP)殘留檢測試劑盒 2025-12-05
- 浙江疫苗產品支原體檢測指示細胞培養法 2025-12-05
- 廣東免疫細胞產品支原體檢測可比性驗證 2025-12-05
- 重慶重組藥物支原體檢測NAT法 2025-12-05
- 廣東免疫細胞產品支原體檢測國產替代 2025-12-05
- 浙江CHO宿主細胞蛋白(HCP)殘留檢測 2025-12-05
- 河北復雜基質支原體檢測方法學驗證 2025-12-05
- 江西干細胞產品支原體檢測技術服務 2025-12-05
- 上海細胞療法產品支原體檢測技術服務 2025-12-05
推薦新聞
- 工業園區標準聚醚醚酮 2025-12-06
- 安徽國產助腿器服務熱線 2025-12-06
- 燕麥纖維中恩特膳 2025-12-06
- 東莞古法今制養生茶加盟連鎖店 2025-12-06
- 蘇州介紹人工智能輔助診斷設備銷售方法 2025-12-06
- 海南是什么助膝器旅游 2025-12-06
- 高新區提供一次性注射器銷售電話 2025-12-06
- 江西國內助踝器加盟連鎖店 2025-12-06
- 西湖區生物檢測試劑盒 2025-12-06
- 安徽包含什么手術無影燈生產企業 2025-12-06