山東X射線-熒光X射線-熒光雙模態成像系統執行標準
雙模態成像的納米毒性評估:骨骼系統的安全性研究通過X射線評估納米材料在骨骼的沉積部位(如骨骺vs骨干),熒光標記的氧化應激指標(如8-OHdG探針)量化細胞毒性,系統在納米顆粒骨毒性研究中發現:沉積于骨骺的納米顆粒可使局部骨密度下降15%,且熒光標記的氧化應激信號升高2倍,與組織病理學的骨細胞空泡化評分相關性達0.88。這種雙模態評估為骨科納米材料的安全性評價提供結構-分子雙重證據,助力材料的毒理學優化。X射線—熒光雙模態成像系統的便攜式探頭設計,支持術中骨腫塊切除的實時邊界確認。雙模態同步采集技術讓X射線—熒光成像系統在骨折愈合研究中量化骨痂形成與血管新生。山東X射線-熒光X射線-熒光雙模態成像系統執行標準

手術導航與術后評估:全流程診療支持雙模態系統貫穿骨腫塊診療全周期:術前通過X射線-熒光成像制定切除范圍(如腫塊邊界外5mm),術中實時導航確保切緣陰性,術后通過雙模態復查評估骨愈合(X射線骨痂密度)與腫瘤復發(熒光標記殘留細胞)。在兔脛骨腫塊模型中,該全流程方案使腫塊局部控制率達90%,且術后6周的骨愈合評分(X射線骨密度+熒光血管密度)較傳統手術提升40%,展現“診斷-醫治-評估”的一體化優勢。 磁兼容設計的雙模態系統可與MRI設備聯動,補充軟組織信息與骨骼分子成像數據。山東X射線-熒光X射線-熒光雙模態成像系統執行標準X射線—熒光雙模態成像系統的參數化報告生成功能,自動輸出骨結構與分子標記的量化指標。
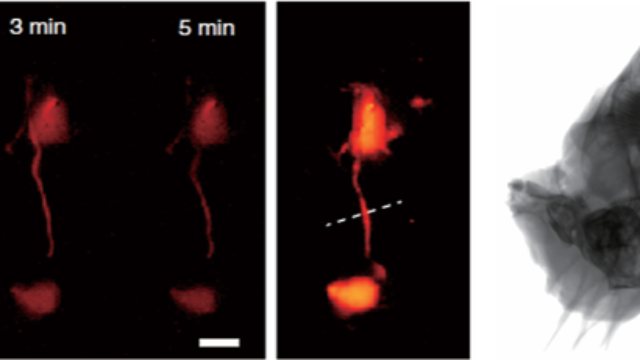
術中放療劑量引導:雙模態影像的醫治優化結合X射線的骨結構成像與熒光標記的放療敏感器(如H2AX探針),系統在骨腫塊術中放療中實時評估劑量分布:X射線定位腫塊邊界,熒光監測放療誘導的DNA損傷(熒光強度與劑量呈線性相關,R2=0.98)。該技術可避免傳統放療的劑量盲區,在犬骨腫塊模型中使腫塊局部控制率提升30%,同時通過熒光信號調控放療劑量,將正常骨組織的輻射損傷降低50%,實現“精細放療-保護正常組織”的雙重目標。該系統在骨代謝疾病中通過X射線評估骨轉換率,熒光標記代謝相關蛋白酶活性。
雙模態成像的教育訓練系統:科研技能快速提升配套的虛擬訓練系統包含X射線骨結構識別、熒光探針選擇及雙模態配準等模塊,通過模擬不同骨疾病的雙模態影像(如骨折、**、炎癥),幫助科研人員掌握影像判讀與數據分析技能。訓練系統內置的AI評分功能可對學員的病灶檢測、參數測量進行實時反饋,平均培訓周期從傳統的3個月縮短至2周,尤其適合骨科、影像科新手快速掌握雙模態成像技術。雙模態系統的X射線熒光光譜分析功能,同步檢測骨礦物質成分與分子探針信號。雙模態系統在骨轉移研究中通過X射線識別溶骨病灶,熒光標記腫瘤細胞活性。

雙模態引導的干細胞移植:骨骼再生的精細調控在骨缺損修復中,X射線定位缺損區域(如直徑5mm的顱骨缺損),熒光標記間充質干細胞(GFP+)的移植軌跡,系統可量化細胞在缺損區的聚集效率(24小時達85%)及成骨分化程度(OCN熒光強度隨時間上升2.1倍)。結合X射線的新骨礦化評估(術后4周骨密度達正常的60%),該技術為干細胞療法的劑量優化與移植路徑設計提供可視化依據,使骨再生效率提升40%。 低溫制冷的熒光相機與脈沖式X射線源協同,使系統實現快速雙模態數據采集(<10秒/次)。實時圖像融合算法讓X射線—熒光成像系統在骨科微創手術中同步顯示骨結構與腫塊邊界。甘肅小動物X射線-熒光雙模態成像系統咨詢問價
高速雙模態采集(20幀/秒)可記錄骨折瞬間的骨微損傷與血小板活化的熒光信號響應。山東X射線-熒光X射線-熒光雙模態成像系統執行標準
雙模態成像的未來技術升級:AI+多模態的智能融合系統預留AI算法接口與多模態擴展端口,未來可集成機器學習模型(如基于Transformer的骨疾病預測網絡)與質譜成像(MALDI),實現“X射線結構-AI預測-熒光驗證-質譜代謝”的四維分析。在概念驗證實驗中,AI模型基于雙模態數據預測骨腫塊的轉移風險(AUC=0.95),并通過質譜成像驗證預測區域的代謝異常(如脂質代謝通路打開),為骨骼疾病的精細醫學研究開辟“影像-分子-代謝”的多維研究范式。山東X射線-熒光X射線-熒光雙模態成像系統執行標準
- 黑龍江X射線-熒光X射線-熒光雙模態成像系統哪里有賣的 2025-11-27
- 西藏近紅外二區顯微成像系統品牌排行 2025-11-27
- 上海近紅外二區熒光壽命成像系統解決方案 2025-11-27
- 河北近紅外二區全光譜小動物活體成像系統回收價 2025-11-27
- 浙江X射線-熒光近紅外二區熒光壽命成像系統設計 2025-11-27
- 上海熒光全光譜小動物活體成像系統常用知識 2025-11-27
- 中國香港近紅外二區X射線-熒光雙模態成像系統廠家直銷 2025-11-27
- 江西近紅外二區顯微成像系統推薦廠家 2025-11-27
- 中國香港成像系統近紅外二區熒光寬場成像系統維保 2025-11-27
- 河南全光譜小動物成像系統歡迎選購 2025-11-27
- 貴州本地西門子PLC 2025-12-10
- 江蘇單槽基因擴增儀PCR儀一般多少錢 2025-12-10
- 浦東新區品牌電子產品維保 2025-12-10
- 泵類振動巡測儀 2025-12-10
- 上海地鐵信息化軟件與平臺 2025-12-10
- 江蘇如何選智能差壓變送器生產企業 2025-12-10
- 迅杰光遠IAS-3120玉米胚芽檢測儀器多少錢 2025-12-10
- 安徽PR-Xv30單組份點膠售后服務 2025-12-10
- 深圳超聲波閥控水表供應 2025-12-10
- 中國澳門節能地樓宇監控哪里有賣的 2025-12-10