湖北近紅外二區X射線-熒光雙模態成像系統品牌排行
術中實時導航:骨**切除的精細邊界確認便攜式雙模態探頭(重量<1.5kg)集成低劑量X射線源(50kV)與近紅外熒光探測器,在手術中可實時獲取骨**的X射線解剖定位(如骨皮質侵蝕范圍)與ICG熒光標記的**邊緣(分辨率0.1mm)。臨床前實驗顯示,該技術使骨**切除的殘留率從傳統手術的25%降至5%,配合AI輔助診斷模塊自動識別X射線異常區域并疊加熒光偽彩,為骨科微創手術提供“眼見為實”的精細導航。 X射線—熒光雙模態成像系統的參數化報告生成功能,自動輸出骨結構與分子標記的量化指標。在骨擴散研究中,X射線—熒光成像系統識別骨皮質破壞,熒光標記細菌生物膜分布。湖北近紅外二區X射線-熒光雙模態成像系統品牌排行

骨微結構與分子互作:高分辨雙模態解析系統的X射線顯微成像(5μm分辨率)可清晰顯示骨小梁的連接度(Conn.D)與厚度(Tb.Th),而熒光顯微模塊(1μm分辨率)能標記破骨細胞(TRAP探針)的活性位點。在骨質疏松模型中,雙模態成像發現骨小梁斷裂處的破骨細胞熒光強度較完整區域高2.3倍,且X射線所示的骨密度下降與熒光標記的RANKL表達呈正相關(r=0.87),這種“結構-分子”的關聯分析為抗骨吸收藥物研發提供直接靶點證據。在骨創傷修復中,系統通過X射線評估骨折愈合進程,熒光標記血管內皮生長因子表達。新疆小動物X射線-熒光雙模態成像系統代理價錢X射線—熒光雙模態成像系統的骨微CT與熒光顯微的聯合成像,解析骨小梁微結構與細胞分子互作。
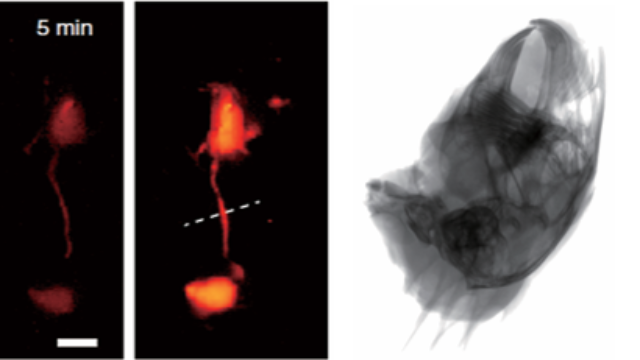
骨靶向藥物評估:分布與療效的全鏈條追蹤通過X射線定位骨骼解剖結構,熒光標記骨靶向納米藥物(如1100nm標記的阿倫磷酸鈉偶聯納米粒),系統可量化藥物在骨組織的蓄積效率(24小時達15.6%ID/g)及亞細胞分布(溶酶體逃逸率35%)。在骨質疏松醫治實驗中,雙模態成像顯示藥物蓄積量與新骨形成面積(X射線量化)的相關性達0.93,且能實時觀察藥物從血液循環到骨表面的動態過程,為骨靶向藥物的劑型優化提供可視化依據。該系統的雙模態數據管理平臺支持多時間點影像的縱向對比與量化分析。
低溫制冷熒光檢測:微弱信號的高靈敏捕捉熒光模塊采用-90℃深度制冷的InGaAs相機,將暗電流抑制至0.01e?/pixel/sec,可檢測皮摩爾級的骨靶向探針信號。在骨微轉移研究中,該技術能識別骨髓腔內103個腫瘤細胞的熒光信號,較傳統可見光成像靈敏度提升10倍,且通過X射線定位轉移灶的解剖位置,避免因組織深度導致的定位偏差,為骨轉移*的早期診斷提供“微量信號-精細定位”的解決方案。 X射線—熒光雙模態成像系統的骨密度定量分析模塊,結合熒光信號評估成骨細胞功能活性。該系統在骨關節炎研究中通過X射線評估軟骨下骨變化,熒光標記炎癥因子表達。

磁兼容設計:多模態影像的互補融合系統的模塊化設計支持與MRI設備聯動,先通過X射線-熒光雙模態獲取骨骼結構與分子標記數據,再用MRI補充軟組織信息(如腫塊周圍水腫),形成“骨骼-腫塊-微環境”的多元化評估。在脊柱腫塊研究中,雙模態與MRI的融合影像可同時顯示椎骨破壞(X射線)、腫瘤細胞分布(熒光)及脊髓壓迫程度(MRI),為手術方案設計提供三維立體參考,較單一模態的信息完整性提升60%。低劑量X射線掃描(<1mGy)與高靈敏度熒光檢測結合,實現長期縱向的骨骼分子成像。雙模態成像的光譜分離技術,消除X射線散射對熒光信號的干擾,提升數據純凈度。湖北近紅外二區X射線-熒光雙模態成像系統品牌排行
X射線—熒光雙模態成像系統的便攜式探頭設計,支持術中骨腫塊切除的實時邊界確認。湖北近紅外二區X射線-熒光雙模態成像系統品牌排行
雙模態成像的考古學應用:古生物骨骼的非破壞性研究針對考古骨骼樣本,系統通過低劑量X射線(<0.01mGy)解析化石骨微結構(如哈弗斯系統形態),熒光光譜分析(1000-1700nm)檢測有機殘留物(如膠原蛋白熒光),在古人類化石研究中發現:尼安德特人化石的骨小梁連接度較現代人類高15%,且熒光光譜顯示膠原蛋白保存度達30%。這種非破壞性雙模態技術為考古學研究提供分子與結構的雙重證據,避免傳統切片對珍貴化石的破壞。該系統在骨關節炎研究中通過X射線評估軟骨下骨變化,熒光標記炎癥因子表達。湖北近紅外二區X射線-熒光雙模態成像系統品牌排行
- 黑龍江X射線-熒光X射線-熒光雙模態成像系統哪里有賣的 2025-11-27
- 西藏近紅外二區顯微成像系統品牌排行 2025-11-27
- 上海近紅外二區熒光壽命成像系統解決方案 2025-11-27
- 河北近紅外二區全光譜小動物活體成像系統回收價 2025-11-27
- 浙江X射線-熒光近紅外二區熒光壽命成像系統設計 2025-11-27
- 上海熒光全光譜小動物活體成像系統常用知識 2025-11-27
- 中國香港近紅外二區X射線-熒光雙模態成像系統廠家直銷 2025-11-27
- 江西近紅外二區顯微成像系統推薦廠家 2025-11-27
- 中國香港成像系統近紅外二區熒光寬場成像系統維保 2025-11-27
- 河南全光譜小動物成像系統歡迎選購 2025-11-27
- 中國澳門節能地樓宇監控哪里有賣的 2025-12-10
- 哈爾濱鎧裝熱電偶報價 2025-12-10
- 威海研究無創睡眠監測系統 2025-12-10
- 云南游離氯分析儀表電話 2025-12-10
- 網絡基礎設施監控 2025-12-10
- 杭州灌溉行業電磁流量計 2025-12-10
- 鹽城應用廣恒溫箱商家 2025-12-10
- 廣州扭轉扭力測試設備 2025-12-10
- 合肥品牌船舶自動化監測報警系統市場價 2025-12-10
- 嘉興工業油液檢測智能監測平臺 2025-12-10