山東脾病理切片銷售
伊紅染色的效果與溶液pH值密切相關,這一特性決定了其在組織學染色中的關鍵作用。伊紅作為一種酸性染料,其分子結構中含有的酸性基團能夠與細胞質中的堿性成分(如蛋白質的氨基)通過靜電引力結合。研究表明,當伊紅染液的pH值維持在4.6-5.0的弱酸性范圍時,染料分子處于比較好電離狀態,既能保證與組織成分的充分結合,又能維持染液的穩定性。這個pH范圍是經過大量實驗驗證得出的經驗值,在此條件下染色,細胞質能呈現鮮艷的粉紅色,與蘇木精染色的藍色細胞核形成鮮明對比。堿性磷酸酶染色用于標記血管內皮細胞,在**血管生成研究中可量化微血管密度。山東脾病理切片銷售
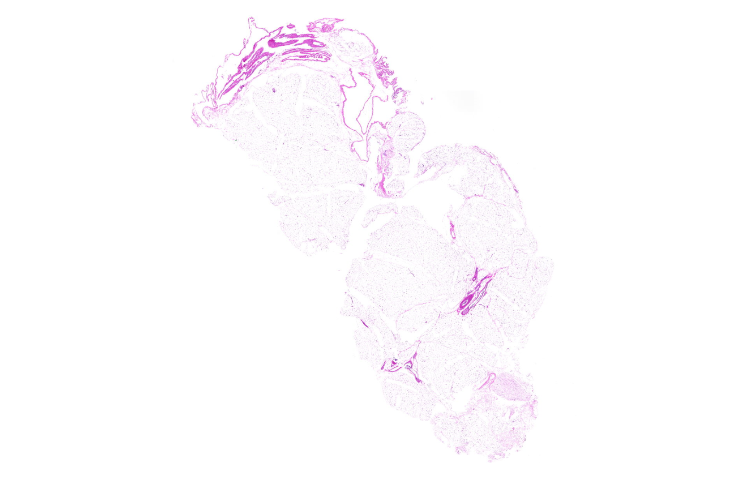
優化方案包括:氧化增強法:對纖維化組織(如糖尿病腎小球硬化)可延長氧化至20分鐘,并加入0.1%Tween-20促進滲透分層染色技術:對厚切片(>5μm)采用階梯式氧化(先3分鐘表面氧化,再10分鐘全層氧化)質控體系建立:每批次染色需設置肝組織陽性對照和淀粉酶消化陰性對照(消化時間37℃×30分鐘)***研究表明,采用微波輔助氧化(800W×2分鐘)可使糖原檢出靈敏度提升40%,尤其適用于穿刺小標本。實驗室應建立Schiff試劑監控記錄,記錄開封日期、使用次數及陽性對照結果,確保染色可靠性(建議每50張切片更換新試劑)。對于疑難病例,可同步進行PAS-Diastase染色(淀粉酶消化后糖原陰性而其他PAS陽性物質保留),實現特異性鑒別。廣東心臟病理切片售后服務磷鎢酸蘇木精(PTAH)染色可顯示橫紋肌的橫紋結構,在心肌病變或橫紋肌肉瘤診斷中具有特異性。
LFB染色(Luxol fast blue染色)是神經病理學中特異性顯示髓鞘結構的經典染色技術,其原理基于LFB染料的陽離子特性與髓鞘中酸性脂蛋白的靜電結合。標準染色流程需嚴格控制條件:石蠟切片脫蠟至水后,浸入0.1%LFB染液(60℃預熱)中孵育8-16小時(過夜染色效果比較好),隨后用95%乙醇洗去多余染料;關鍵分化步驟采用0.05%鋰碳酸溶液處理30-90秒,在顯微鏡監控下至白質呈現亮藍色而灰質近乎無色,***用焦油紫或中性紅復染神經元胞體。.
油紅O染色作為中性脂肪檢測的金標準,其技術難點在于脂肪組織極易在染色過程中溶解丟失。為比較大限度保持脂質完整性,需采取以下系統性防護措施:樣本前處理階段固定后必須流水沖洗12小時以上,徹底***殘留甲醛(甲醛會破壞脂蛋白結構)冰凍切片厚度控制在8-10μm,過薄(<5μm)會導致脂滴破裂預冷載玻片(4℃)上貼片,減少組織回溫造成的脂質擴散染色過程控制采用改良染液配方:0.3%油紅O(60%異丙醇+40%蒸餾水配制),過濾后4℃避光保存(有效期7天)染色缸預冷至10℃,染色時間精確控制在8分鐘(室溫染色時縮短至5分鐘)分化使用60%異丙醇(而非傳統85%濃度),分化時間不超過10秒封片與質控免脫水直接封片:染色后PBS稍沖洗,立即用含5%聚乙烯醇的甘油明膠封固設置雙對照:陽性對照(正常脂肪組織)監測染色效率,陰性對照(異丙醇脫脂處理)驗證特異性數字化分析:采用ImageJ軟件定量染色面積(閾值設定RGB R>180)阿爾辛藍染色通過顯示酸性黏多糖鑒別黏液性**,在胃腸道及卵巢**分類中具有重要價值。

PAS染色中糖原檢測的假陰性問題主要源于三個關鍵環節的失控:氧化不充分、Schiff試劑失效和切片厚度不當。在氧化步驟中,必須使用新鮮配制的1%高碘酸溶液(避光保存≤2周),氧化時間嚴格控制在10-15分鐘(室溫20-25℃)。當檢測富含糖原的組織(如肝組織或橫紋肌)時,建議每5分鐘顯微鏡下觀察氧化程度,直至基底膜呈現輕微膨脹狀態(提示多糖充分暴露)。Schiff試劑的有效性可通過空白對照試驗驗證:滴加試劑于已知陽性組織,30分鐘內未出現紫紅色反應即提示失效(正常試劑應使糖原在5分鐘內顯色)。鐵染色(普魯士藍反應)可檢測組織內鐵沉積,為血色病或慢性溶血性貧血提供病理學證據。內蒙古肝臟病理切片服務電話
高碘酸金胺染色用于結核桿菌快速篩查,熒光顯微鏡下桿菌呈現亮黃色顯著提高檢出率。山東脾病理切片銷售
分化與返藍是HE染色中調節細胞核顯色的關鍵步驟,其操作精度直接影響染色質量和診斷準確性。分化過程使用1%鹽酸乙醇溶液(通常由1ml濃鹽酸與99ml 70%乙醇配制),其主要作用是選擇性去除細胞質中非特異性結合的蘇木精染料,同時保留細胞核內的強結合染料,從而增強核質對比度。實際操作中需嚴格控制分化時間(通常5-30秒),并在顯微鏡下動態觀察,以細胞核結構清晰可見而細胞質基本無色為比較好終點。分化不足會導致背景過深,細胞核與細胞質界限模糊;分化過度則可能使細胞核染色過淺,丟失重要診斷信息。
山東脾病理切片銷售
- 河南國內科研一抗一般多少錢 2025-12-05
- 云南Masson全景掃描歡迎選購 2025-12-05
- 黑龍江ELISA試劑盒方案 2025-12-05
- 海南腦組織全景掃描一般多少錢 2025-12-05
- 山西羊ELISA試劑盒歡迎選購 2025-12-05
- 陜西魚ELISA試劑盒咨詢報價 2025-12-05
- 中國臺灣進口ELISA試劑盒大概多少錢 2025-12-05
- 南京國產科研一抗型號 2025-12-05
- 廣西脾病理切片服務電話 2025-12-05
- 天津免疫熒光全景掃描售價 2025-12-05
- 高新區提供一次性注射器銷售電話 2025-12-06
- 西湖區生物檢測試劑盒 2025-12-06
- 安徽包含什么手術無影燈生產企業 2025-12-06
- 河北是什么安思爾成交價 2025-12-06
- 云南試劑盒誠信合作 2025-12-06
- 特色陽生智能采樣預約管理平臺型號 2025-12-06
- 廣東進口的試劑盒銷售廠家 2025-12-06
- 定制脊柱臺車 2025-12-06
- 吳中區標準干粉吸入器銷售廠家 2025-12-06
- 上海專業環氧乙烷滅菌方法 2025-12-06